Grade 10 - Science
-
Chapter 1
ජීවයේ රසායනික පදනම7 Topics|1 Quiz -
Chapter 2සරල රේඛීය චලිතය7 Topics|1 Quiz
-
Chapter 3පදාර්ථයේ ව්යුහය7 Topics|1 Quiz
-
Chapter 4චලිතය පිළිබඳ නිව්ටන් නියම3 Topics|1 Quiz
-
Chapter 5ඝර්ෂණය4 Topics|1 Quiz
-
Chapter 6ශාක හා සත්ත්ව සෛලවල ව්යුහය හා කෘත්ය5 Topics|1 Quiz
-
Chapter 7මූලද්රව්ය හා සංයෝග ප්රමාණනය4 Topics|1 Quiz
-
Chapter 8ජීවින්ගේ ලාක්ෂණික8 Topics|1 Quiz
-
Chapter 9සම්ප්රයුක්ත බලය4 Topics|1 Quiz
-
Chapter 10රසායනික බන්ධන5 Topics|1 Quiz
-
Chapter 11බලයක භ්රමණ ආචරණය2 Topics|1 Quiz
-
Chapter 12බල සමතුලිතතාව4 Topics
-
Chapter 13ජෛව ලෝකය2 Topics
-
Chapter 14ජීවයේ අඛණ්ඩතාව4 Topics
-
Chapter 15ද්රවස්ථිති පීඩනය හා එහි යෙදීම්5 Topics
-
Chapter 16පදාර්ථයේ වෙනස් වීම්5 Topics
-
Chapter 17ප්රතික්රියා ශීඝ්රතාව1 Topic
-
Chapter 18කාර්යය, ශක්තිය හා ජවය3 Topics
-
Chapter 19ධාරා විද්යුතය7 Topics
-
Chapter 20ප්රවේණිය7 Topics|1 Quiz
Quizzes
Participants 129
ඉංග්රීසි හෝඩියේ අඩංගු වන්නේ අක්ෂර 26 කි. එහෙත් එම අක්ෂර සංයෝජනයෙන් වචන විශාල සංඛ්යාවක් සෑදෙයි. මූලද්රව්ය ඇත්තේ ද සීමිත සංඛ්යාවකි. එහෙත් එම මූලද්රව්ය රසායනික ව සංයෝජනයෙන් සංයෝග මිලියන ගණනක් සෑදෙයි. මූලද්රව්ය බොහොමයක් රසායනික සංයෝග සෑදුව ද, සාමාන්ය තත්ත්ව යටතේ සංයා්ග සෑදීමට සහභාගී නොවන මූලද්රව්ය ද ඇත. හීලියම්, නියොන්, ආගන් ඒ සඳහා උදාහරණ වේ.
ස්වභාවයෙන් තනි පරමාණු වශයෙන් පවතින මේ මූලද්රව්ය වායු වශයෙන් පවතී. ඒවා උච්ච වායු ලෙස හැඳින්වේ. බොහෝ මූලද්රව්ය සංයෝග සැදීමටත්, උච්ච වායු සංයෝග නොසෑදීමටත් හේතුව කුමක්ද? මූලද්රව්යවල ඉලෙක්ට්රෝන වින්යාස සලකා බැලීමෙන් එය පැහැදිලි කළ හැකි ය
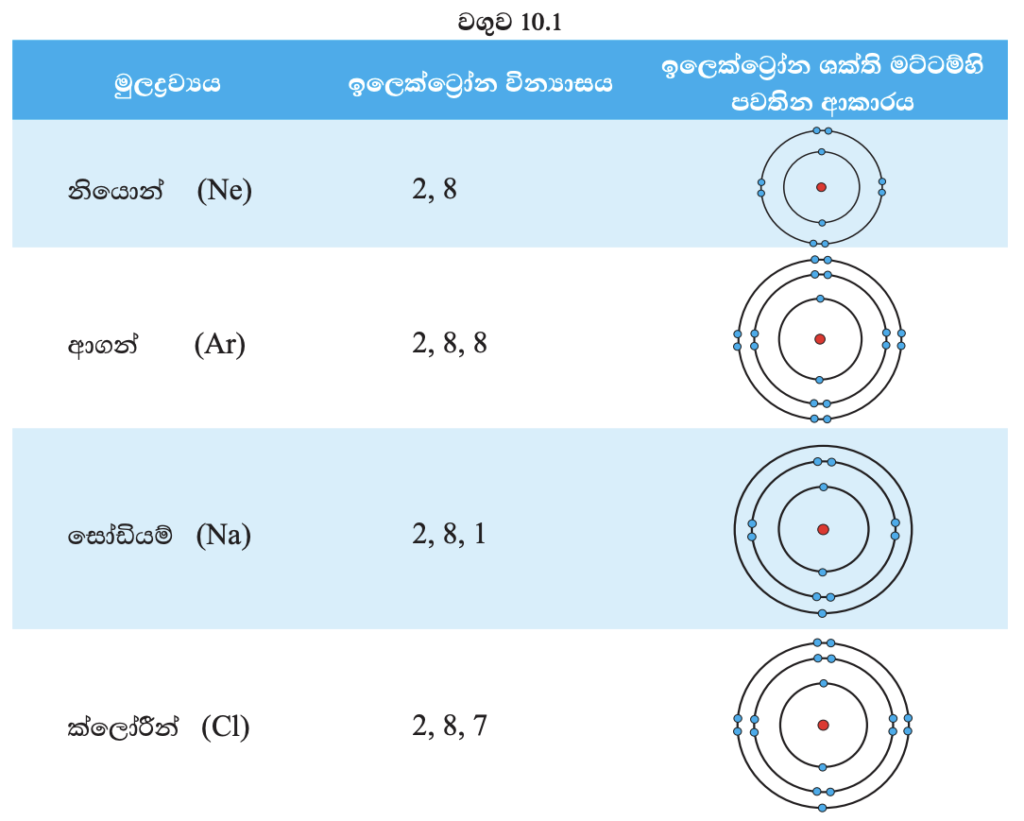
මූලද්රව්ය පරමාණුවක ඉලෙක්ට්රෝන පවතින බාහිරතම කවචය සංයුජතා කවචය ලෙස හැඳින්වේ.
නියොන් හා ආගන් පරමාණුවල සංයුජතා කවචයේ ඉලෙක්ට්රෝන අටක් බැගින් තිබේ. මෙම ඉලෙක්ට්රෝන වින්යාස ස්ථායි වින්යාසයක් ලෙස හඳුනාගෙන ඇත. මෙම ස්ථායි වින්යාසය නිසා මේවායේ ප්රතික්රියාශීලීත්වය ඉතා අඩු ය. එබැවින් මෙම මූලද්රව්ය උච්ච වායු ලෙස හැඳින්වේ. එහෙත් සෝඩියම් හා ක්ලෝරීන් පරමාණු සැලකූ විට එම තත්ත්වය වෙනස් ය. සෝඩියම් පරමාණුවට ස්ථායි උච්ච වායු ඉලෙක්ට්රෝන වින්යාසය ලබාගැනීමට අවසාන කවචයේ ඉලෙක්ට්රෝනය ඉවත් කිරීමට හෝ ඉලෙක්ට්රෝන හතක් ලබාගැනීමට හෝ සිදු වේ. එසේ ම ක්ලෝරීන් පරමාණුවට ස්ථායි ඉලෙක්ට්රෝන වින්යාසය ලබාගැනීමට ඉලෙක්ට්රෝන එකක් ලබාගැනීම හෝ ඉලෙක්ට්රෝන හතක් පිටකිරීම සිදු කළ යුතු ය. ස්ථායි ඉලෙක්ට්රෝන වින්යාසය ලබා ගැනීම උදෙසා මෙම මූලද්රව්ය පරමාණුවල සංයුජතා කවචයේ ඉලෙක්ට්රෝන ප්රතිසංවිධානය වීම සිදු වේ. ප්රතිසංවිධානය උදෙසා ඉලෙක්ට්රෝන ලබාගැනීම හෝ පිටකිරීම හෝ හවුලේ තබා ගැනීම හෝ සිදු වේ.
මෙලෙස මූලද්රව්ය පරමාණු ස්ථායි වීම උදෙසා සංයුජතා කවචයේ ඉලෙක්ට්රෝන ප්රතිසංවිධානය කරගැනීමෙන් පරමාණු අතර හෝ අයන අතර හෝ ඇති වන ආකර්ෂණ බල හෙවත් බැදීම් රසායනික බන්ධන ලෙස හැඳින්වේ.
රසායනික බන්ධන සැදීමේ දී ඊට සහභාගි වන පරමාණු හැසිරෙන ආකාරය අනුව රසායනික බන්ධන වර්ග දෙකකට බෙදිය හැකි ය.
- අයනික බන්ධන (ionic bonds)
- සහසංයුජ බන්ධන (covalent bonds)

Responses