ප්රතික්රියා ශීඝ්රතාව කෙරෙහි බලපාන සාධක
යම් රසායනික ප්රතික්රියාවක් සිදුවීමේදී එහි ප්රතික්රියක අංශු (පරමාණු හෝ අණු) අතර ඇති රසායනික බන්ධන බිදී නව බන්ධන ගොඩ නැගීිම නිසා, වෙනස් වූ ඵල හටගනී. මෙසේ බන්ධන බිඳීම සහ නව බන්ධන ගොඩනැගීම සඳහා ප්රතික්රියක අංශු එකිනෙක ගැටිය යුතුය. එමෙන්ම ගැටෙන ප්රතික්රියක අංශු ඵල බවට පත්වීමටනම් ඒවා සතුව ප්රමාණවත් ශක්තියක් තිබිය යුතුය. ප්රතික්රියා ශීඝ්රතාව සඳහා බලපාන සාධක පහත දැක්වේ.
ප්රතික්රියකවල පෘෂ්ඨ වර්ගඵලය
ප්රතික්රියාව සිදුවන උෂ්ණත්වය
ප්රතික්රියකවල සාන්ද්රණය (වායුමය ප්රතික්රියක සඳහා නම් පීඩනය)
උත්ප්රේරක පැවතීම
● ප්රතික්රියකවල පෘෂ්ඨ වර්ගඵලය
විශාල දර කොටයක් කුඩා කැබලිවලට පැලූ විට පහසුවෙන් දැවිය හැකි ය. ආහාර ජීරණය පහසුවීම සඳහා ඒවා හොඳින් විකා ගිලින ලෙස වෛද්යවරු උපදෙස් දෙති. මේවාට හේතු මොනවාද ?
ඝන ද්රව්යයක් ද්රවයක් සමග හෝ වායුවක් සමග හෝ ප්රතික්රියා කිරීමේදී ප්රතික්රියාව සිදුවන්නේ ඝනයේ පෘෂ්ඨය මතදී පමණි. මෙයට හේතුව ප්රතික්රියක අංශු එකිනෙක හා ගැටෙන්නේ ඝනයේ පෘෂ්ඨය මතදී පමණක් වීමයි. මේ පිළිබඳව සොයා බැලීමට පැවරුම 17.2 හි නිරතවෙමු.
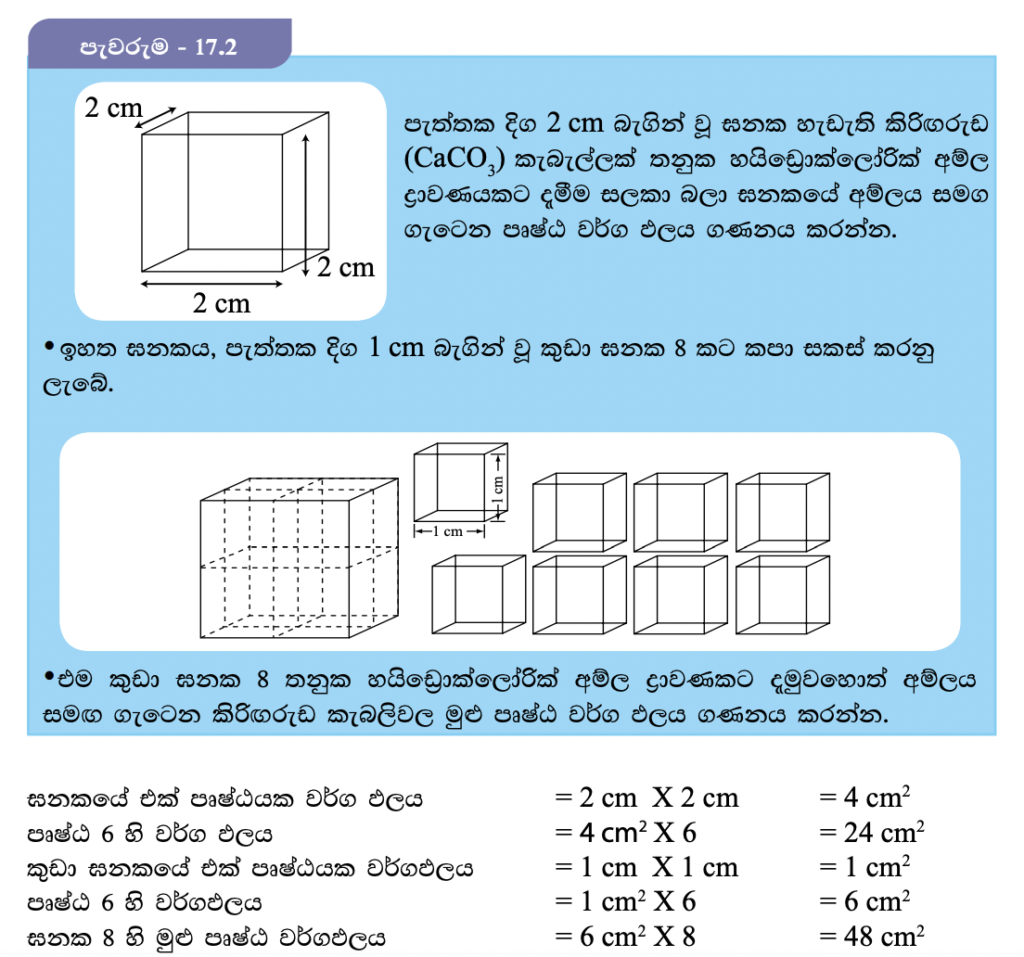
මේ අනුව ඝනකය කුඩා ඝනක බවට පත් කළ විට පෘෂ්ඨ වර්ගඵලය වැඩි වන බව පැහැදිලි වේ.
ප්රතික්රියා ශීඝ්රතාව කෙරෙහි ප්රතික්රියකවල පෘෂ්ඨ වර්ගඵලය බලපාන අන්දම සෙවීමට 17.1 ක්රියාකරකමෙහි යෙදෙමු.
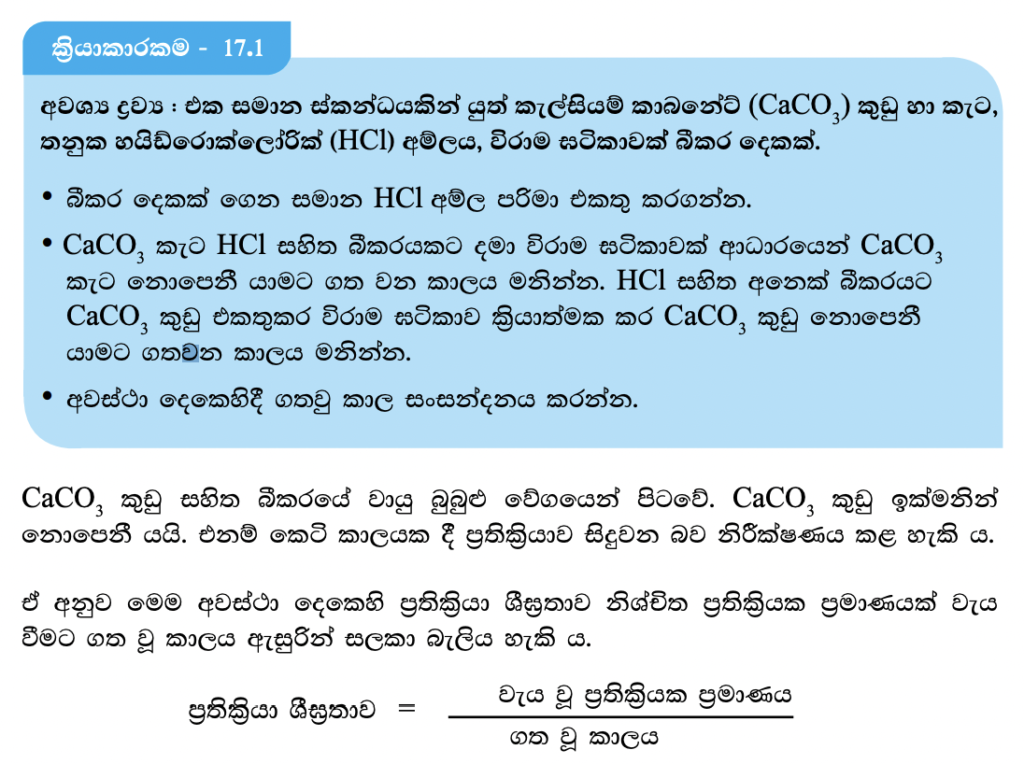
CaCO3 කුඩු ලෙස යොදාගත් විට ප්රතික්රියා ශීඝ්රතාව වැඩිවන බව මින් තහවුරු වේ. මේ අනුව ප්රතික්රියකවල පෘෂ්ඨ වර්ගඵලය වැඩිවන විට ප්රතික්රියා ශීඝ්රතාව වැඩිවන බව නිගමනය කළ හැකි ය. ප්රතික්රියකවල පෘෂ්ඨ වර්ගඵලය වැඩිවන විට ප්රතික්රියක අංශු එකිනෙක සමග ඇතිකරන ගැටුම් ප්රමාණය ඉහළ යන බැවින් ප්රතික්රියා ශීඝ්රතාව වැඩි වේ.
● ප්රතික්රියාව සිදු වන උෂ්ණත්වය
ආහාර නරක් වන්නේ ජෛව රසායනික ප්රතික්රියා සිදුවීම නිසා ය. ආහාර නරක් නොවී හොඳ තත්ත්වයෙන් දිගු කලක් තබා ගැනීම සඳහා ශීතකරණ හෝ අධිශීතකරණ භාවිත කෙරේ. මෙයින් පැහැදිලි වන්නේ අඩු උෂ්ණත්වවල දී ජෛව රසායනික ප්රතික්රියාවල ශීඝ්රතාව අඩු වන බවයි.
සීනි ජලයේ දිය කිරීමේදී ඇල් ජලයට වඩා පහසුවෙන් උණු ජලයේ දියවන බව ඔබ අත් දැක ඇත. රසායනික ප්රතික්රියාවක ශීඝ්රතාව කෙරෙහි උෂ්ණත්වය කෙසේ බලපාන්නේ දැ යි සොයා බැලීම සඳහා 17.2 ක්රියාකාරකමෙහි නියැලෙමු.
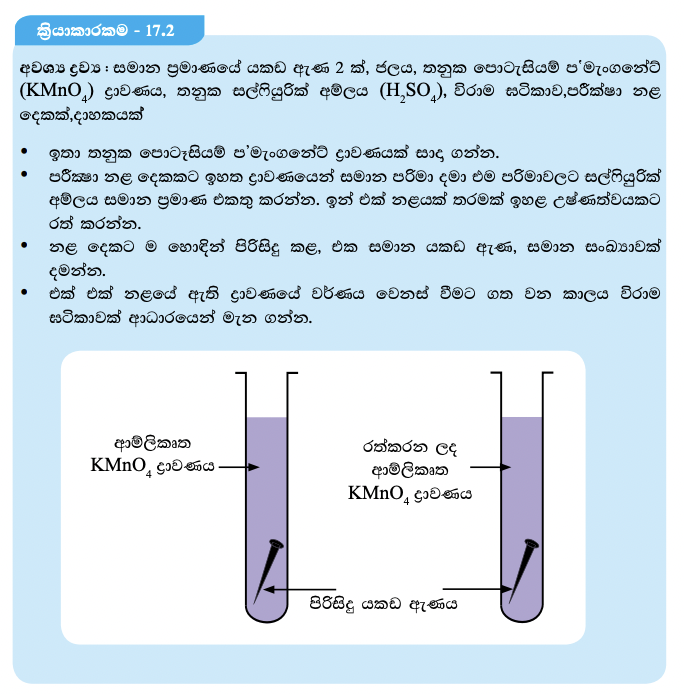
ඉහත ක්රියාකාරකමේදී, ඉහළ උෂ්ණත්වයේ ඇති පොටෑසියම් ප’මැංගනේට් ද්රාවණය අඩු කාලයක දී විවර්ණ වන බව පෙනේ. උෂ්ණත්වය වැඩි වෙත්ම ප්රතික්රියාවල ශීඝ්රතාව වැඩිවන බව මේ අනුව නිගමනය කළ හැකි ය. වැඩි උෂ්ණත්වයකදී ප්රතික්රියක අංශුවල චාලක ශක්තිය වැඩි ය. එවිට ඒකක කාලයකදී ඒවා අතර ඇතිවන ගැටීම් සංඛ්යාව වැඩි වේ. එබැවින් ප්රතික්රියා ශීඝ්රතාව ද වැඩි වේ.
● ප්රතික්රියකවල සාන්ද්රණය
රසායනික ප්රතික්රියාවල ශීඝ්රතාව කෙරෙහි ප්රතික්රියකවල සාන්ද්රණය බලපාන්නේ කෙසේ දැ යි සොයා බැලීම සඳහා පහත 17.3 ක්රියාකාරකම කළ හැකි ය.
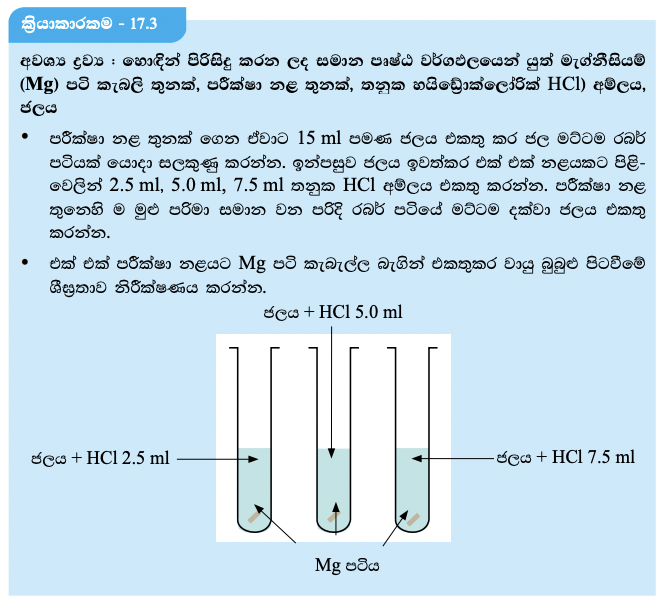
වැඩිපුර HCL අම්ලය එකතු කළ අවස්ථාව එනම් HCL සාන්ද්රණය වැඩි අවස්ථාවේ වායු බුබුළු පිටවීමේ ශීඝ්රතාව වැඩි බව නිරීක්ෂණය වේ. මේ අනුව පැහැදිලි වන්නේ HCL සාන්ද්රණය වැඩිවෙත් ම ප්රතික්රියා ශීඝ්රතාව වැඩි වී ඇති බවයි.
ප්රතික්රියක සාන්ද්රණය වැඩි වෙත් ම ඒකක පරිමාවක් තුළ ඇති එම ප්රතික්රියක අංශු සංඛ්යාව වැඩි වේ. එබැවින් ඒකක කාලයකදී ප්රතික්රියක අංශු අතර ඇතිවන ගැටුම් සංඛ්යාව ද වැඩි වේ. ප්රතික්රියකවල සාන්ද්රණය වැඩිවෙත් ම ප්රතික්රියා ශීඝ්රතාව වැඩිවන්නේ මේ නිසාය.
● වායුමය ප්රතික්රියකවල පීඩනය
වායුමය ප්රතික්රියක සහභාගී වන ප්රතික්රියාවලදී, පීඩනය වැඩි කිරීමෙන් ප්රතික්රියා ශීඝ්රතාව වැඩි කළ හැකි ය. පහත 17.1 රූපයේ A සහ B අවස්ථා සලකා බලන්න.

් සහ ඊ අවස්ථා දෙකේදී ම ඇත්තේ එකම ප්රතික්රියක ස්කන්ධයකි. එහෙත් ඊ හි පරිමාව අඩු කොට ඇති බැවින් එහි ප්රතික්රියකවල පීඩනය ් හි පීඩනයට වඩා වැඩිය. එවිට ඒකක කාලයකදී එකිනෙක ගැටෙන ප්රතික්රියක අංශු සංඛ්යාව වැඩි බැවින් ප්රතික්රියා ශීඝ්රතාව වැඩිවේ.
● උත්ප්රේරක
රසායනික ප්රතික්රියාවක ශීඝ්රතාව වැඩි කරන නමුත් ප්රතික්රියාවේදී වැය නොවන ද්රව්ය උත්ප්රේරක ලෙස හැඳින්වේ. රසායනික ප්රතික්රියාවක ශීඝ්රතාව කෙරෙහි උත්ප්රේරකවල බලපෑම සොයා බැලීම සඳහා කළ හැකි ක්රියාකාරකමක් පහත දැක්වේ.

මැංගනීස් ඩයොක්සයිඩ් සහිත පරීක්ෂා නළයේ වායු බුබුළු පිටවීමේ ශීඝ්රතාව වැඩිය. මෙම ප්රතික්රියාවේ ශීඝ්රතාව වැඩි කිරීමට මැංගනීස් ඩයොක්සයිඩ් හේතු වී ඇත. මෙහිදී මැංගනීස් ඩයොක්සයිඩ්වල ස්කන්ධය වෙනස් වී නොමැති බැවින් ප්රතික්රියාවේදී මැංගනීස් ඩයොක්සයිඩ් වැය වී නැත. එනම් මැංගනීස් ඩයොක්සයිඩ් මෙහි දී උත්ප්රේරකයක් ලෙස ක්රියාකර ඇත. ප්රතික්රියාවක ශීඝ්රතාව වැඩි කරන මෙන් ම අඩු කරන ද්රව්ය ද ඇත. එසේ ප්රතික්රියා ශීඝ්රතාව අඩුකරන ද්රව්ය නිශේධක හෙවත් මන්දක ලෙස හැඳින්වේ.
නිදසුන්:- හයිඩ්රජන් පෙරොක්සයිඩ්වල වියෝජන ශීඝ්රතාව අඩුකිරීම සඳහා සල්ෆියුරික් අම්ල බිංදුවක් එකතු කිරීම.
විශාල ප්රතික්රියක ප්රමාණයක් සඳහා උත්ප්රේරක කුඩා ප්රමාණයක් සෑහේ. ඒ ඒ ප්රතික්රියාව සඳහා විශිෂ්ට වූ උත්ප්රේරක ඇත. ප්රතික්රියාව සිදුවීමේදී උත්ප්රේරකයේ භෞතික ස්වභාවය වෙනස් විය හැකි වුව ද, අවසාන වශයෙන් එම උත්ප්රේරකයේ රසායනික වෙනසක් සිදු නොවේ. විවිධ කර්මාන්ත සහ කාර්මික ක්රියාවලි සඳහා උත්ප්රේරක ඉතා බහුල ලෙස භාවිත කෙරේ. එම තොරතුරු කිහිපයක් 17.1 වගුවේ දැක්වේ.

