පරමාණුව පිළිබඳ ග්රහ ආකෘතිය
පරමාණුව පිළිබඳ ග්රහ ආකෘතිය ඉදිරිපත් කරන ලද්දේ අර්නස්ට් රදර්ෆඩ් විසිනි. පරමාණුව තුළ ඇති ධන ආරෝපණ ඒකරාශී වූ න්යෂ්ටිය වටා ඉලෙක්ට්රෝන චලිතයේ යෙදෙමින් පවතී. එය ග්රහලෝක සූර්යයා වටා භ්රමණය වීමට සමාන කර දැක්විය හැකි ය (3.1 රූපය).
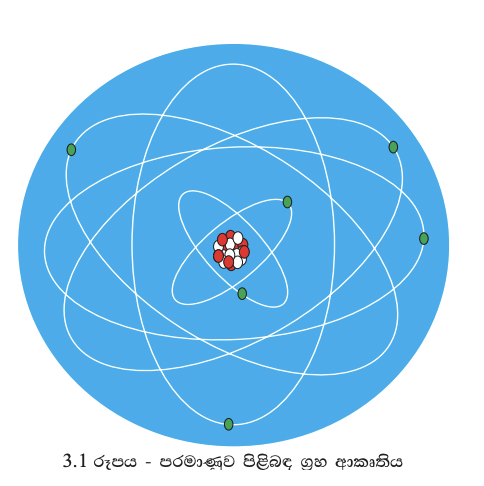
න්යෂ්ටියේ ඇති ධන ආරෝපණය මඟින් ඉලෙක්ට්රෝන න්යෂ්ටිය වෙතට ආකර්ෂණය වන නමුත් ඒවා න්යෂ්ටිය මතට පතිත නො වේ. ඊට හේතුව න්යෂ්ටිය වටා ඉලෙක්ට්රෝන
ඉතා වේගයෙන් භ්රමණය වීමයි. රදර්ෆඩ්ගේ ආකෘතිය තවදුරටත් විස්තර කළ නීල්ස් බෝර් ප්රකාශ කළේ ධන ආරෝපිත න්යෂ්ටිය වටා ඇති නිශ්චිත පථවල හෙවත් කක්ෂවල ඉලෙක්ට්රෝන චලිතයේ යෙදෙන බවයි.
පරමාණුව වටා ඉලෙක්ට්රෝන භ්රමණය වන කක්ෂ අයත්වනුයේ පරමාණුවේ පිහිටි කවච වලටයි. මෙම කවච න්යෂ්ටියේ සිට පිටතට පිළිවෙළින් 1, 2, 3, 4… හෝ K,L,M,N, …. ලෙස ද හැඳින්වේ. මේවා ශක්ති මට්ටම් ලෙස ද හැඳින්වේ. එක් එක් ශක්ති මට්ටමට නියමිත ශක්තියක් පවතී. න්යෂ්ටියේ සිට ඉවතට යන විට මෙම ශක්තිය ද ක්රමයෙන් වැඩි වේ. නමුත් ශක්ති මට්ටම් අතර පරතරය අඩු වේ (3.2 රූපය). පරමාණුවක ඕනෑ ම ශක්ති මට්ටමක තිබිය හැකි උපරිම ඉලෙක්ට්රෝන සංඛ්යාවක් ඇත. පළමු ශක්ති මට්ටම් හතරෙහි පැවතිය හැකි උපරිම ඉලෙක්ට්රෝන සංඛ්යා 3.1 වගුවේ දක්වා ඇත.


■ පරමාණුක ක්රමාංකය
මූලද්රව්ය පරමාණුවක අඩංගු ප්රෝටෝන සංඛ්යාව එහි පරමාණුක ක්රමාංකය (atomic number) ලෙස හැඳින්වේ. එනම්,
මූලද්රව්යයේ පරමාණුක ක්රමාංකය = මූලද්රව්යයේ පරමාණුවක ඇති ප්රෝටෝන සංඛ්යාව
නිදසුනක් ලෙස ගතහොත් සෝඩියම් පරමාණුවක න්යෂ්ටියේ ප්රෝටෝන 11 ක් අඩංගු වේ. එම නිසා සෝඩියම්වල පරමාණුක ක්රමාංකය 11 කි. එක ම මූලද්රව්යයක සෑම
පරමාණුවක ම අඩංගු ප්රෝටෝන සංඛ්යාව සමාන වේ. එකිනෙකට වෙනස් මූලද්රව්යවල අඩංගු ප්රෝටෝන සංඛ්යා එකිනෙකට වෙනස් ය. එබැවින් එකිනෙකට වෙනස් මූලද්රව්ය පරමාණු දෙකක පරමාණුක ක්රමාංක කිසි විටෙකත් සමාන නොවේ. මේ නිසා මූලද්රව්යයක පරමාණුක ක්රමාංකය එම මූලද්රව්යයට අනන්ය ලක්ෂණයකි. නිදසුනක් ලෙස සැලකුව හොත් මූලද්රව්යයක පරමාණුක ක්රමාංකය 6 නම් ඉන් අදහස් වන්නේ එම මූලද්රව්යය කාබන් බවයි. වෙනත් කිසිදු මූලද්රව්යයක පරමාණුක ක්රමාංකය 6 නොවේ. මූලද්රව්යයක පරමාණුක ක්රමාංකය ’ වලින් නිරූපණය කරයි. උදාසීන පරමාණුවක අඩංගු ප්රෝටෝන සංඛ්යාව එහි ඉලෙක්ට්රෝන සංඛ්යාවට සමාන වේ. එබැවින් මූලද්රව්යයක පරමාණුක ක්රමාංකය එම මූලද්රව්ය පරමාණුවක ඇති ඉලෙක්ට්රෝන සංඛ්යාවට ද සමාන බව සැලකිය හැකි ය. එහෙත් රසායනික ප්රතික්රියා සිදු වීමේදී පරමාණුවලින් ඉලෙක්ට්රෝන ඉවත් වීමක් හෝ ඒවාට ඉලෙක්ට්රෝන එකතු වීමක් සිදු විය හැකි ය. මෙවැනි ආරෝපිත පරමාණු හඳුන්වනු ලබන්නේ අයන යනුවෙනි. අයනයක ඉලෙක්ට්රෝන සංඛ්යාව ප්රෝටෝන සංඛ්යාවට අඩු හෝ වැඩි විය හැකි ය. එහෙත් යම් පරමාණුවකින් සෑදෙන අයනයක ප්රෝටෝන සංඛ්යාව වෙනස් නොවන බැවින් පරමාණුක ක්රමාංකය වෙනස් නොවේ.
■ ස්කන්ධ ක්රමාංකය
පරමාණුවක අඩංගු ප්රෝටෝන, නියුට්රෝන සහ ඉලෙක්ට්රෝන යන මූලික උප පරමාණුක අංශු අතුරින් ඉලෙක්ට්රෝන ඉතාමත් සැහැල්ලු ය. ප්රෝටෝන සහ නියුට්රෝනවල ස්කන්ධ ආසන්න වශයෙන් සමාන වේ. ආසන්න වශයෙන් ඉලෙක්ට්රෝනයක ස්කන්ධය ප්රෝටෝනයක ස්කන්ධයෙන් 1/1840 කි. පරමාණුවක අඩංගු ඉලෙක්ට්රෝනවල ස්කන්ධය ප්රෝටෝන හා නියුට්රෝනවල ස්කන්ධ සමග සැසඳෙන විට නොගිනිය හැකි තරම් කුඩා ය. එහෙයින් පරමාණුවේ ස්කන්ධය කෙරෙහි බලපාන්නේ ප්රෝටෝන සහ නියුට්රෝනවල ස්කන්ධ පමණි. පරමාණුවක න්යෂ්ටියේ අඩංගු ප්රෝටෝන සංඛ්යාවේත් නියුට්රෝන සංඛ්යාවේත් ඓක්යය ස්කන්ධ ක්රමාංකය (mass number) යනුවෙන් හැඳින්වේ.
… ස්කන්ධ ක්රමාංකය = ප්රෝටෝන සංඛ්යාව + නියුට්රෝන සංඛ්යාව
මූලද්රව්යයක ස්කන්ධ ක්රමාංකය සංකේතයෙන් නිරූපණය කෙරේ.
O සෝඩියම්වල පරමාණුක ක්රමාංකය 11ක් වේ.
O එබැවින් සෝඩියම් පරමාණුවක ප්රෝටෝන 11ක් ඇත.
O එහි අඩංගු වන්නේ නියුට්රෝන 12ක් නම්,
සෝඩියම් පරමාණුවේ ස්කන්ධ ක්රමාංකය = 11 + 12 = 23 කි.
මූලද්රව්යයක පරමාණුක ක්රමාංකය හා ස්කන්ධ ක්රමාංකය ලියා දැක්වීමේ සම්මත ක්රමයක් ඇත. අදාළ මූලද්රව්යයේ සංකේතයේ වම් පස පහළින් පරමාණුක ක්රමාංකය ද වම්පස ඉහළින් ස්කන්ධ ක්රමාංකය ද යොදනු ලැබේ.

ස්කන්ධ ක්රමාංකය හා පරමාණුක ක්රමාංකය අතර අන්තරයෙන් ලැබෙන්නේ පරමාණුවේ අඩංගු නියුට්රෝන සංඛ්යාවයි.
