අයනික බන්ධන
සෝඩියම් (Na) පරමාණුවේ ඉලෙක්ට්රෝන වින්යාසය 2, 8, 1 වේ. සෝඩියම් අඩු විද්යුත් ඝෘණතා අගයක් සහිත මූලද්රව්යයකි. සෝඩියම් පරමාණුව සතු ප්රෝටෝන ගණන ඉලෙක්ට්රෝන ගණනට සමාන නිසා මෙම පරමාණුව විද්යුත් වශයෙන් උදාසීන ය (10.1 රූපය).

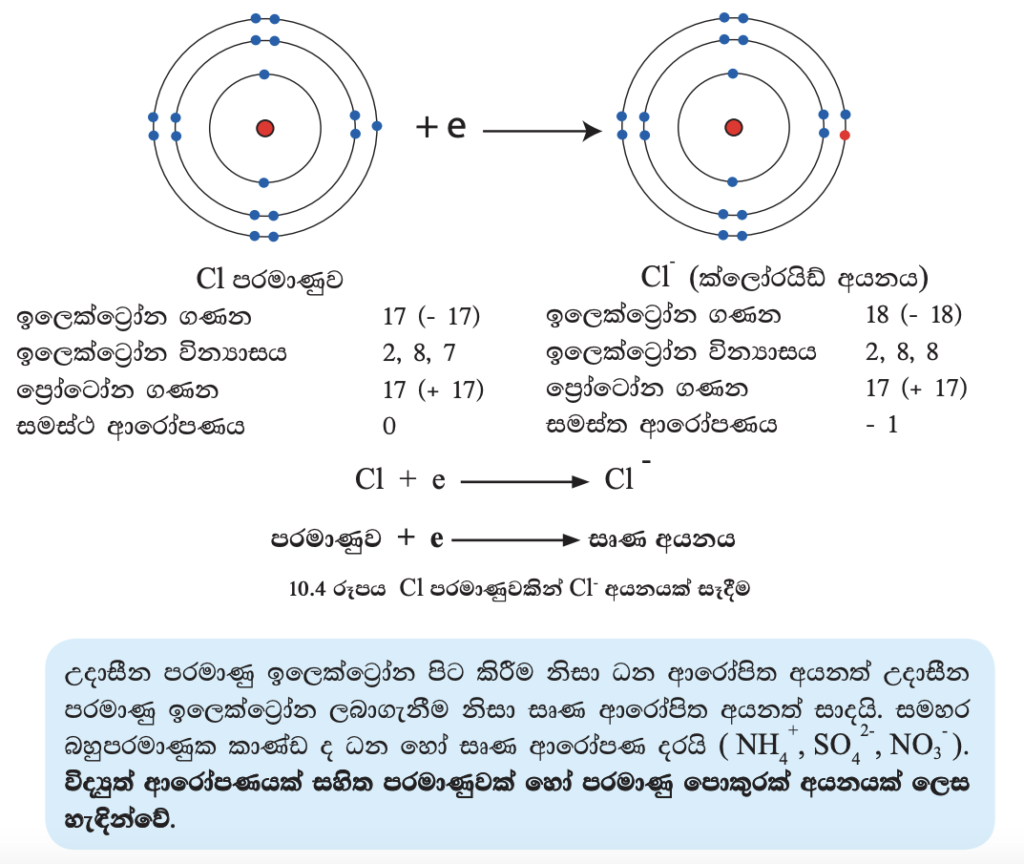
මෙහි බාහිර ශක්ති මට්ටමේ ඇති ඉලෙක්ට්රෝනය පිට කිරීම නිසා එය +1 ක ආරෝපණයක් සහිත සෝඩියම් අයනයක් (Na+) බවට පත් වේ (10.2 රූපය). පරමාණුවකට ආරෝපණයක් ලැබීමෙන් පසු එය හඳුන්වන්නේ අයනයක් ලෙසයි. මෙම අයනයට + ආරෝපණයක් ඇති බැවින් එය ධන අයනයක් හෙවත් කැටායනයක් ලෙස හැඳින්වේ. අයනයක රසායනික ගුණ පරමාණුවක රසායනික ගුණවලට වඩා වෙනස් වේ.

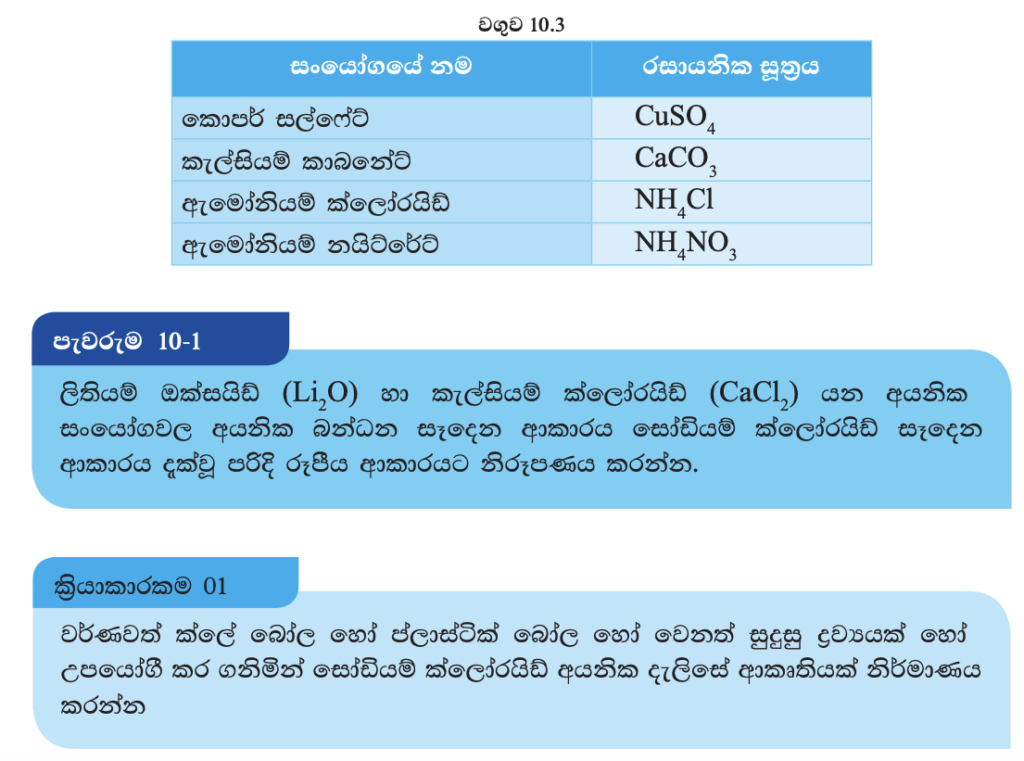
ක්ලෝරීන් පරමාණුවේ ඉලෙක්ට්රෝන වින්යාසය 2, 8, 7 වේ. ක්ලෝරීන් ඉහළ විද්යුත් ඍණතා අගයක් සහිත මූලද්රව්යයකි. ප්රතිවිරුද්ධ ආරෝපණ සමාන නිසා මෙම පරමාණුව විද්යුත් වශයෙන් උදාසීන ය. (10.3 රූපය).

ක්ලෝරීන් (Cl) පරමාණුවේ බාහිර ශක්ති මට්ටමට ඉලෙක්ට්රෝනයක් ලබා ගැනීම නිසා එය සෘණ එකක (-1) ආරෝපණයක් ඇති ක්ලෝරයිඩ් අයනය (Cl-) සාදයි (10.4 රූපය). මෙම අයනයට සෘණ ආරෝණයක් ඇති බැවින් එය සෘණ අයනයක් හෙවත් ඇනායනයක් ලෙස හඳුන්වනු ලැබේ.
සෝඩියම් ක්ලෝරයිඩ් සංයෝගය සෑදෙන ආකාරය මී ළඟට විමසා බලමු. සෝඩියම් පරමාණුවලින් ඉලෙක්ට්රෝන පිට කිරීමෙන් සෑදෙන සෝඩියම් ධන අයනත් ක්ලෝරීන් පරමාණු ඉලෙක්ට්රෝන ලබා ගැනීමෙන් ඇති වන ක්ලෝරයිඩ් සෘණ අයනත් ප්රතිවිරුද්ධ ව ආරෝපිත නිසා එකිනෙකා හා දැඩි ව ස්ථිති විද්යුත් ආකර්ෂණවලින් බැඳී සෝඩියම් ක්ලෝරයිඩ් නම් අයනික බන්ධන සහිත සංයෝගය සෑදෙයි. මෙම ක්රියාව 10.5 රූපයෙන් නිරූපණය කර ඇත.
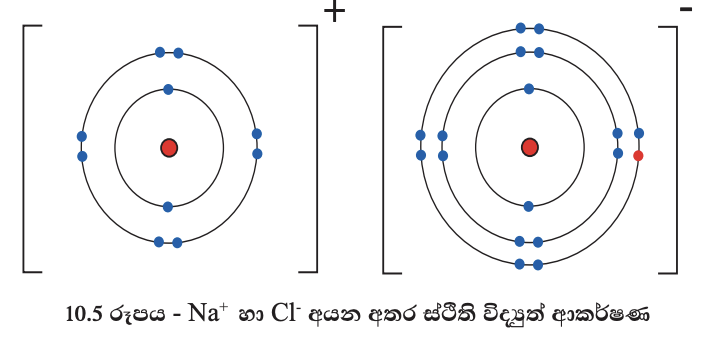
එක් පරමාණුවකින් තවත් පරමාණුවකට ඉලෙක්ට්රෝන ප්රදානය කිරීම නිසා ප්රතිඵල වු ධන හා සෘණ අයන අතර, ඇතිවන ප්රබල ස්ථිති විද්යුත් ආකර්ෂණය හේතුවෙන් ඇති වන බන්ධන, අයනික බන්ධන හෙවත් විද්යුත් සංයුජ බන්ධන ලෙස හැඳින්වේ. මේ අනුව සෝඩියම් ක්ලෝරයිඩ් අයනික බන්ධනවලින් සමන්විත සංයෝගයකි. එවැනි සංයෝග අයනික සංයෝග ලෙස හැඳින්වේ.
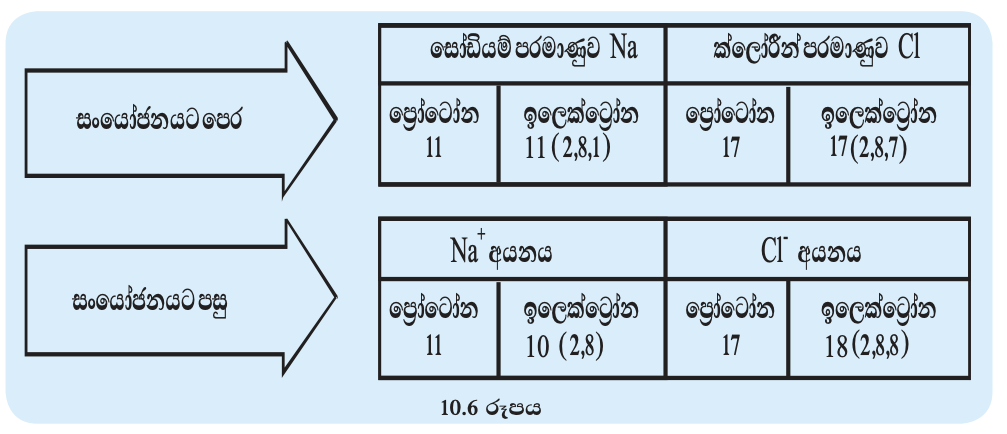
සෝඩියම් ක්ලෝරයිඩ් සෑදීමේ දී පරමාණුවල බාහිර ශක්ති මට්ටමේ ඉලෙක්ට්රෝන සකස් වන අන්දම පහත සටහනේ දැක්වේ.
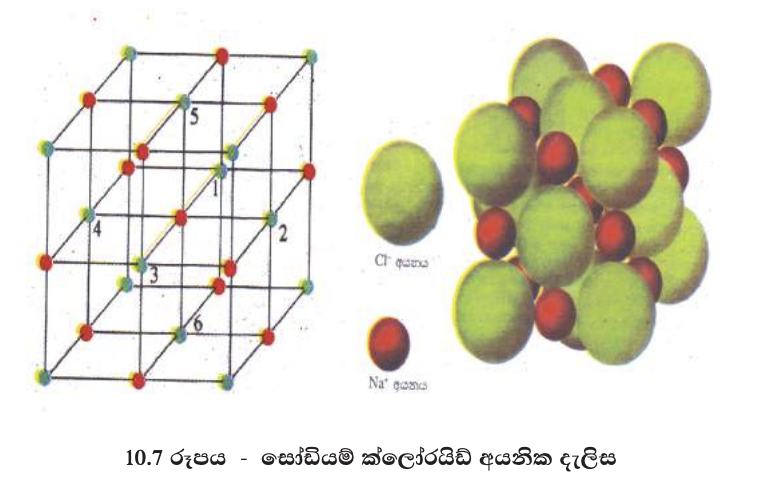
සෝඩියම් ක්ලෝරයිඩ් සංයෝගයේ අයන අතර ආකර්ෂණය එක් Na+ අයනයකට හා Cl- අයනයකට සීමා නොවෙයි. සැම Na+ අයනයක් වටා ම Cl- අයන හයක් පිහිටන පරිදිත් සෑම Cl- අයනයක් වටා ම Na+ අයන හයක් පිහිටන පරිදිත් ධන හා සෘණ අයන විශාල සංඛ්යාවක් ජාලයක් ලෙස සැකසී ආකර්ෂණ බල ඇති කර ගනී. මේ නිසා Na+ හා Cl- අයන ක්රමවත් ව සකස් වී සෝඩියම් ක්ලෝරයිඩ් නිශ්චිත ස්ඵටික දැලිස සෑදෙයි. මෙම දැලිස අයනික දැලිසක් ලෙස හැඳින්වේ(10.7 රූපය). සැම අයනික සංයෝගයක ම අයන සකස් වී ඇත්තේ ත්රිමාන දැලිසක අකාරයට ය.
■ අයනික සංයෝග
බොහෝ විට අයනික බන්ධන හටගන්නේ විද්යුත් ඍණතා අගය අඩු පරමාණුවලින් සෑදෙන ධන අයන හා විද්යුත් ඍණතා අගය ඉහළ පරමාණුවලින් සෑදෙන සෘණ අයන අතර ය. එවැනි අයනික සංයෝග සඳහා නිදසුන් කිහිපයක් 10.2 වගුවේ දැක්වේ.

ඉහත සංයෝගවලට අමතර ව අයන ඛණ්ඩක හා අයන සංයෝජනයෙන් ද අයනික බන්ධන හටගනී. ඒ සඳහා නිදසුන් 10.3 වගුවේ දැක්වේ.