Grade 10 - Science
-
Chapter 1
ජීවයේ රසායනික පදනම7 Topics|1 Quiz -
Chapter 2සරල රේඛීය චලිතය7 Topics|1 Quiz
-
Chapter 3පදාර්ථයේ ව්යුහය7 Topics|1 Quiz
-
Chapter 4චලිතය පිළිබඳ නිව්ටන් නියම3 Topics|1 Quiz
-
Chapter 5ඝර්ෂණය4 Topics|1 Quiz
-
Chapter 6ශාක හා සත්ත්ව සෛලවල ව්යුහය හා කෘත්ය5 Topics|1 Quiz
-
Chapter 7මූලද්රව්ය හා සංයෝග ප්රමාණනය4 Topics|1 Quiz
-
Chapter 8ජීවින්ගේ ලාක්ෂණික8 Topics|1 Quiz
-
Chapter 9සම්ප්රයුක්ත බලය4 Topics|1 Quiz
-
Chapter 10රසායනික බන්ධන5 Topics|1 Quiz
-
Chapter 11බලයක භ්රමණ ආචරණය2 Topics|1 Quiz
-
Chapter 12බල සමතුලිතතාව4 Topics
-
Chapter 13ජෛව ලෝකය2 Topics
-
Chapter 14ජීවයේ අඛණ්ඩතාව4 Topics
-
Chapter 15ද්රවස්ථිති පීඩනය හා එහි යෙදීම්5 Topics
-
Chapter 16පදාර්ථයේ වෙනස් වීම්5 Topics
-
Chapter 17ප්රතික්රියා ශීඝ්රතාව1 Topic
-
Chapter 18කාර්යය, ශක්තිය හා ජවය3 Topics
-
Chapter 19ධාරා විද්යුතය7 Topics
-
Chapter 20ප්රවේණිය7 Topics|1 Quiz
Quizzes
Participants 129
ආවර්තිතා වගුවේ ආවර්තයක් ඔස්සේ වමේ සිට දකුණට යන විට සහ කාණ්ඩයක් දිගේ ඉහළ සිට පහළට යන විට මූලද්රව්යවල භෞතික සහ රසායනික ගුණ ක්රමානුකූල රටාවකට විචලනය වන බව පෙනේ. එම රටා අධ්යයනය සඳහා මූලද්රව්යවල පහත සඳහන් ගුණ සලකා බලමු.
■ පළමුවන අයනීකරණ ශක්තිය (first ionisation energy)
■ විද්යුත් ඍණතාව (electro negativity)
■ පළමුවන අයනීකරණ ශක්තිය
පරමාණුව පිළිබඳ න්යෂ්ටික ආකෘතිය අනුව එහි ඉලෙක්ට්රෝන න්යෂ්ටිය වටා භ්රමණය වෙමින් පවතී. ඍණ ආරෝපිත ඉලෙක්ට්රෝන වෙත ධන ආරෝපිත න්යෂ්ටිය මගින් ආකර්ෂණයක් ඇති කරයි. එබැවින් පරමාණුවකින් ඉලෙක්ට්රෝනයක් ඉවත් කිරීමට නම් එම ආකර්ෂණය අබිබවා යාමට තරම් ශක්තියක් සැපයිය යුතුයි. මෙසේ පරමාණුවකින් ඉලෙක්ට්රෝනයක් ඉවත් කළ විට එය ධන අයනයක් බවට පත් වේ.
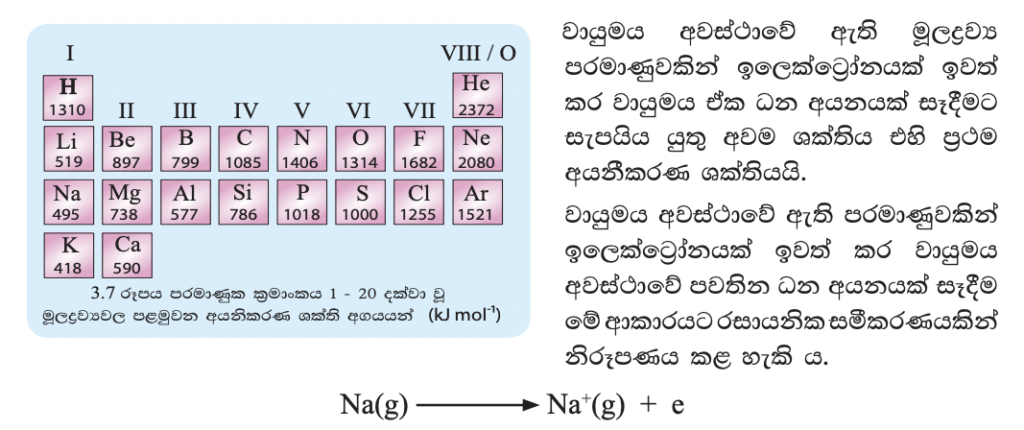
පරමාණුවක් සඳහා මෙම ශක්තිය සාපේක්ෂ ව කුඩා අගයකි. එම නිසා මෙම අගය පරමාණු 6.022 X 10(23) ප්රමාණයක් හෙවත් මවුලයක් සඳහා ඉදිරිපත් කරයි. 3.7 රූපයේ දක්වා ඇත්තේ පරමාණු මවුලයක් සඳහා ඉදිරිපත් කරන ලද අගයන් ය. ඒ අනුව, සෝඩියම්වල පළමු අයනීකරණ ශක්තිය 495 kj mol-1 වේ. ආවර්තයක් සැලකූ විට එහි අඩු ම ප්රථම අයනීකරණ ශක්තිය ඇත්තේ ෂ කාණ්ඩයේ මූල ද්රව්යවලට යි. එමෙන් ම සෑම ආවර්තයක ම උපරිම ප්රථම අයනීකරණ ශක්තිය ඇත්තේ ඪෂ කාණ්ඩයේ මූලද්රව්යයටයි. ආවර්තයක වමේ සිට දකුණට යන විට ක්රමානුකූල රටාවකට ප්රථම අයනීකරණ ශක්තිය විචලනය වේ. 2 වන හා 3 වන ආවර්තවල අයනීකරණ ශක්තිවල විචලන ප්රස්තාරය (3.8 රූපය) ඇසුරෙන් අධ්යයනය කළ විට මේ බව තහවුරු වේ.
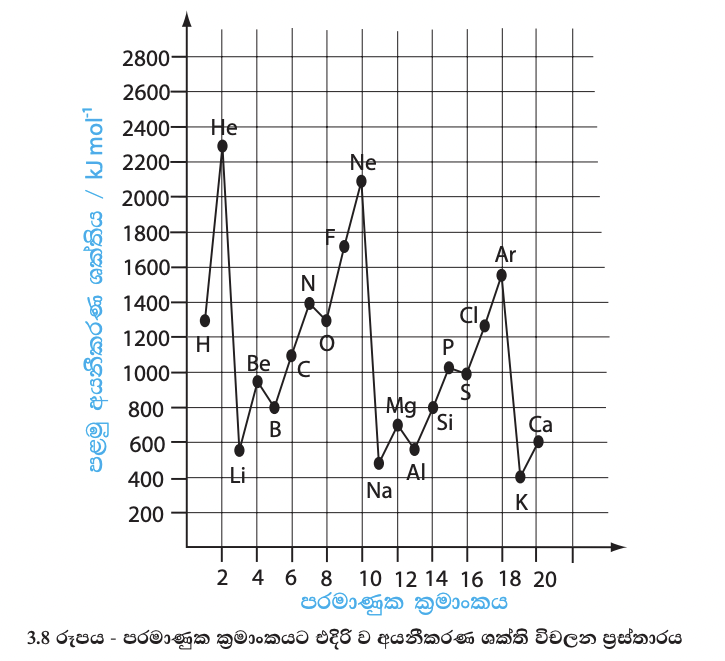

I කාණ්ඩයේ මූලද්රව්යවල කාණ්ඩයේ ඉහළ සිට පහළට ප්රථම අයනීකරණ ශක්ති අගයන් අඩු වී ඇති බව පෙනේ. අනෙකුත් කාණ්ඩවල අගයන් සැලකීමෙන් ද ඔබට මේ බව අවබෝධ කර ගත හැකි ය. ඒ අනුව කාණ්ඩයක ඉහළ සිට පහළට යාමේ දී අයනීකරණ ශක්තිය අඩුවීමක් සිදුවන බව නිගමනය කළ හැකි ය. කාණ්ඩයේ පහළට යන විට මූලද්රව්ය පරමාණුවක් සතු ශක්ති මට්ටම් ගණන වැඩිවන නිසා අවසාන ශක්ති මට්ටමේ ඉලෙක්ට්රෝනවලට න්යෂ්ටියෙන් යෙදෙන ආකර්ෂණය අඩු ය. එබැවින් ඉලෙක්ට්රෝන ඉවත් කිරීම පහසු වේ.
■ විද්යුත් ඍණතාව
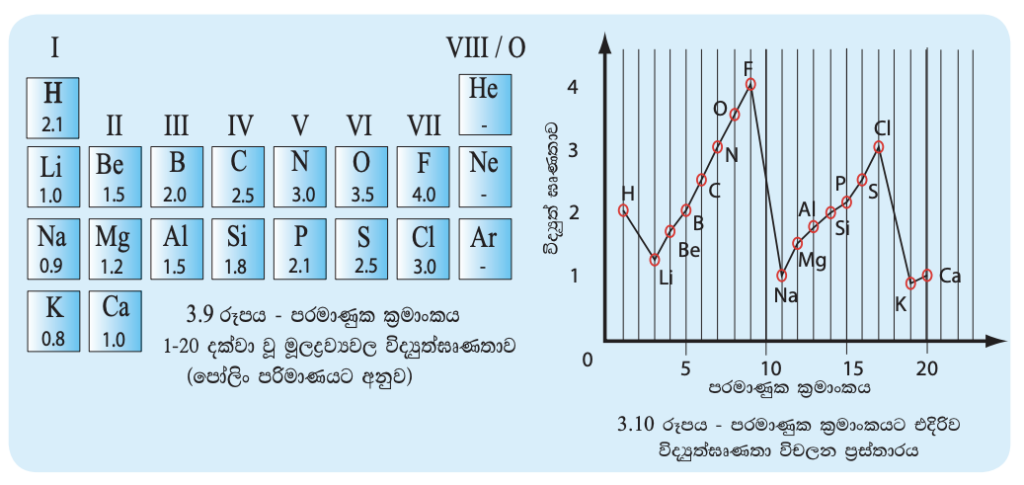
විද්යුත් ඍණතාව යන්නෙන් අදහස් වන්නේ මූලද්රව්ය පරමාණුවක් තවත් මූලද්රව්ය පරමාණුවක් සමග සහසංයුජ බන්ධනයකින් බැඳී ඇති විට එම බන්ධනයේ ඉලෙක්ට්රෝන තමා වෙතට ඇදගැනීමේ හැකියාවයි. විද්යුත් ඍණතාව වැඩි පරමාණුවක් ඉලෙක්ට්රෝන කෙරෙහි දක්වන ආකර්ෂණය විද්යුත් ඍණතාවෙන් අඩු පරමාණුවක එම හැකියාවට වඩා වැඩි ය. රසායනික බන්ධන ඒකකය යටතේ දී විද්යුත් සෘණතාව පිළිබඳ ව වැඩිදුරටත් සාකච්ඡා කෙරේ. විද්යුත් ඍණතාව ප්රකාශ කිරීම සඳහා විවිධ පරිමාණ ඇති අතර අප මෙහි දී සලකා බලනුයේ පෝලිං පරිමාණයයි. පෝලිං පරිමාණය අනුව විද්යුත් ඍණතාවෙන් ඉහළ ම මූලද්රව්ය ලෙස සලකන්නේ ෆ්ලුවොරීන් ය. උච්ච වායු සඳහා විද්යුත් ඍණතා අගයක් පෝලිං පරිමාණයෙහි ලබා දී නැත. (උච්ච වායු රසායනික බන්ධන සෑදීම කෙරෙහි අඩු නැඹුරුවක් ඇත.)

Responses