Grade 10 - Science
-
Chapter 1
ජීවයේ රසායනික පදනම7 Topics|1 Quiz -
Chapter 2සරල රේඛීය චලිතය7 Topics|1 Quiz
-
Chapter 3පදාර්ථයේ ව්යුහය7 Topics|1 Quiz
-
Chapter 4චලිතය පිළිබඳ නිව්ටන් නියම3 Topics|1 Quiz
-
Chapter 5ඝර්ෂණය4 Topics|1 Quiz
-
Chapter 6ශාක හා සත්ත්ව සෛලවල ව්යුහය හා කෘත්ය5 Topics|1 Quiz
-
Chapter 7මූලද්රව්ය හා සංයෝග ප්රමාණනය4 Topics|1 Quiz
-
Chapter 8ජීවින්ගේ ලාක්ෂණික8 Topics|1 Quiz
-
Chapter 9සම්ප්රයුක්ත බලය4 Topics|1 Quiz
-
Chapter 10රසායනික බන්ධන5 Topics|1 Quiz
-
Chapter 11බලයක භ්රමණ ආචරණය2 Topics|1 Quiz
-
Chapter 12බල සමතුලිතතාව4 Topics
-
Chapter 13ජෛව ලෝකය2 Topics
-
Chapter 14ජීවයේ අඛණ්ඩතාව4 Topics
-
Chapter 15ද්රවස්ථිති පීඩනය හා එහි යෙදීම්5 Topics
-
Chapter 16පදාර්ථයේ වෙනස් වීම්5 Topics
-
Chapter 17ප්රතික්රියා ශීඝ්රතාව1 Topic
-
Chapter 18කාර්යය, ශක්තිය හා ජවය3 Topics
-
Chapter 19ධාරා විද්යුතය7 Topics
-
Chapter 20ප්රවේණිය7 Topics|1 Quiz
Quizzes
Participants 129
■ සංයුජතාව
සංයුජතාව යනුවෙන් හඳුන්වනු ලබන්නේ යම් මූලද්රව්ය පරමාණුවක සංයෝජනය වීමේ හැකියාවයි. මෙය මනිනු ලබන්නේ හයිඩ්රජන්වලට සාපේක්ෂවයි. මේ අනුව මූලද්රව්යයක සංයුජතාව යනු එම මූලද්රව්ය පරමාණුවක් සමග සංයෝජනය විය හැකි හෝ ඒ මගින් ප්රතිස්ථාපනය කළ හැකි හෝ හයිඩ්රජන් පරමාණු සංඛ්යාවයි. මූලද්රව්ය පරමාණුවක අවසාන ශක්ති මට්ටමේ ඇති ඉලෙක්ට්රෝන හඳුන්වනු ලබන්නේ සංයුජතා ඉලෙක්ට්රෝන යනුවෙනි.
සමහර මූලද්රව්යවලට සංයුජතා කිහිපයක් තිබිය හැකි ය. මූලද්රව්ය පරමාණුවක ඇති සංයුජතා ඉලෙක්ට්රෝන සංඛ්යාව සාමාන්යයෙන් මූලද්රව්යයේ උපරිම සංයුජතාවට සමාන වේ. මූලද්රව්යයක සංයුජතාවල රසායනික සංයෝජනයේ දී එම මූලද්රව්යයේ පරමාණුවකින් ඉවත් වන ඉලෙකට්රෝන ගණනට හෝ එම මූලද්රව්ය පරමාණුවකින් ලබාගන්නා ඉලෙක්ට්රෝන ගණනට හෝ මූලද්රව්ය පරමාණු අතර හවුලේ පවතින ඉලෙක්ට්රෝන යුගල ගණනට හෝ සමාන වේ.
මූලද්රව්ය පහසුවෙන් හැඳින්වීම සඳහා රසායනික සංකේත භාවිත කරන බව අපි දනිමු.
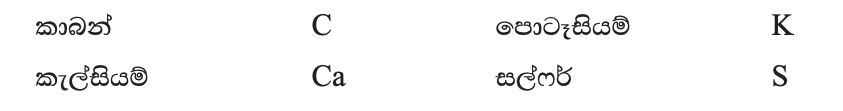
එමෙන් ම සංයෝග පහසුවෙන් හැඳින්වීම සඳහා ද අපි රසායනික සංකේත ඇතුළත් වන ක්රමයක් භාවිතා කරමු. හයිඩ්රජන් පරමාණු දෙකක් හා ඔක්සිජන් පරමාණු එකකින් සැදි ඇති සංයෝගය වන ජලය හැඳින්වීම සඳහා අප යොදා ගන්නේ H2O යන්න ය. මෙය ජලයේ රසායනික සූත්රය ලෙස හඳුන්වනු ලැබේ. රසායනික සූත්රයකදී මූල ද්රව්යයක සංකේතය ළඟට පහළින් අංකයක් ඇතොත් ඉන් දැක්වෙන්නේ සංයෝගයේ අණුවක ඇති එම මූලද්රව්යයේ පරමාණු සංඛ්යාව ය. එවැනි අංකයක් නොමැති නම් එම සංයෝගයේ අණුවක ඇත්තේ එම මූලද්රව්යයේ පරමාණු එකක් බව ය
සංයුජතාව ඇසුරෙන් රසායනික සූත්ර ලිවීම. සංයෝග සැදී ඇත්තේ මූලද්රව්යවල පරමාණු හෝ අයන බන්ධනවලින් බැඳීමෙනි. එබැවින් සංයෝගයක සූත්රය ලිවීමට ඒවායේ සංයෝජන බල හෙවත් සංයුජතා දත යුතු ය. එම සංයෝජන බල තුලනය වන පරිදි සූත්රය ලියනු ලැබේ.
හයිඩ්රජන්වල සංයුජතාව 1 වේ.
ඔක්සිජන්වල සංයුජතාව 2 කි.
මේ අනුව ඔක්සිජන් පරමාණු එකක් සමග හයිඩ්රජන් පරමාණු දෙකක් සංයෝජනය විය හැකි ය.
O මෙය H2O ලෙස ලියනු ලැබේ.
නයිට්රජන්වල සංයුජතාව 3 කි.
මේ අනුව නයිට්රජන් පරමාණු එකක් සමග හයිඩ්රජන් පරමාණු 3 ක් සංයෝජනය විය හැකි ය.
O මෙය NH3 ලෙස ලියනු ලැබේ.
කාබන් හි සංයුජතාව 4 කි. මේ අනුව ක් පරමාණු එකක් සමග හයිඩ්රජන් පරමාණු 4ක් සංයෝජනය විය හැකි ය.
O මෙය CH4 ලෙස ලියනු ලැබේ.
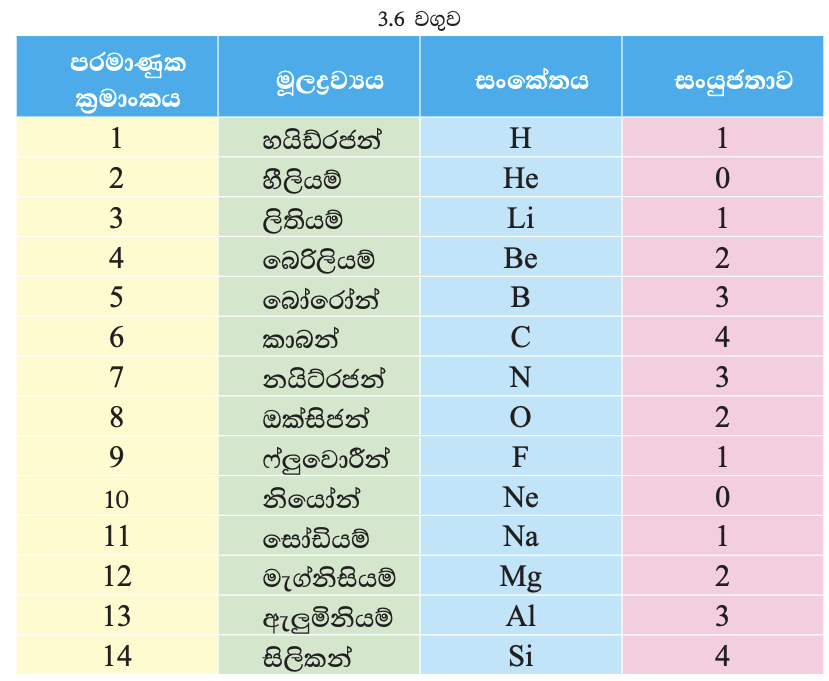
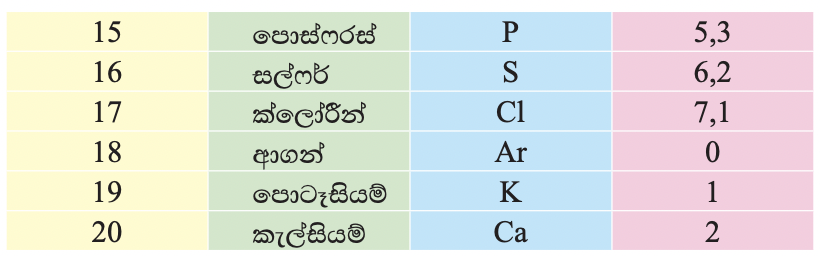
පරමාණුක ක්රමාංකය 1 සිට 20 දක්වා මූලද්රව්යවලට තිබිය හැකි සංයුජතා වගුව
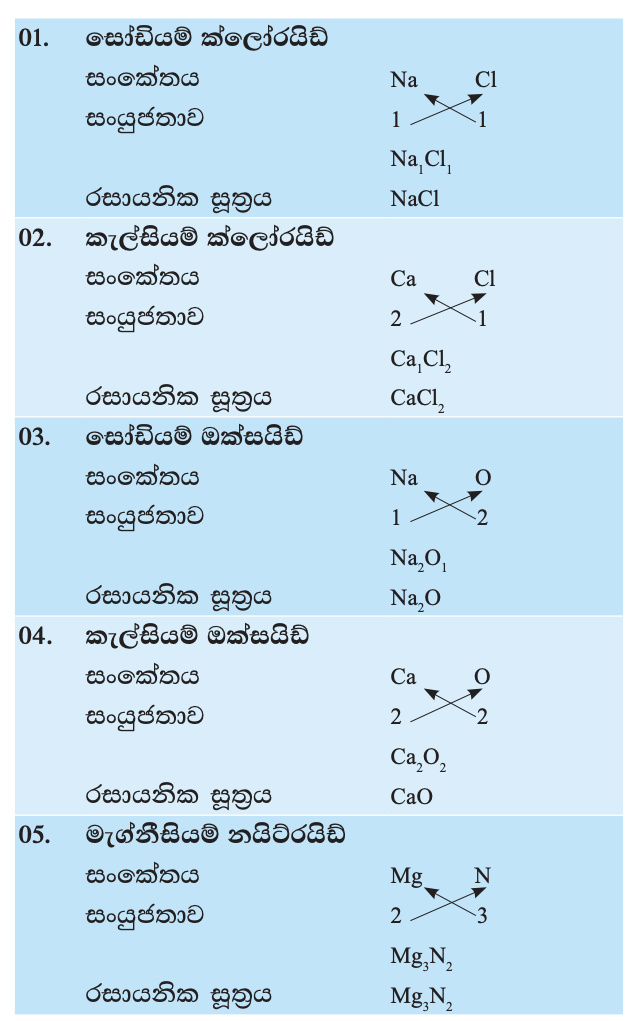
මේ අනුව,
සංයෝගයක රසායනික සූත්රය ලිවීමේ දී සිදු කරනු ලබන්නේ ඒවායේ සංයෝජන බල තුලනය වන පරිදි පරමාණු සම්බන්ධ කිරීම ය. මූලද්රව්ය දෙකෙහි සංකේතවල දකුණු පස පහළින්, මූලද්රව්යවල සංයුජතා මාරුකර ලිවීමෙන් මෙය සිදු කරනු ලැබේ.
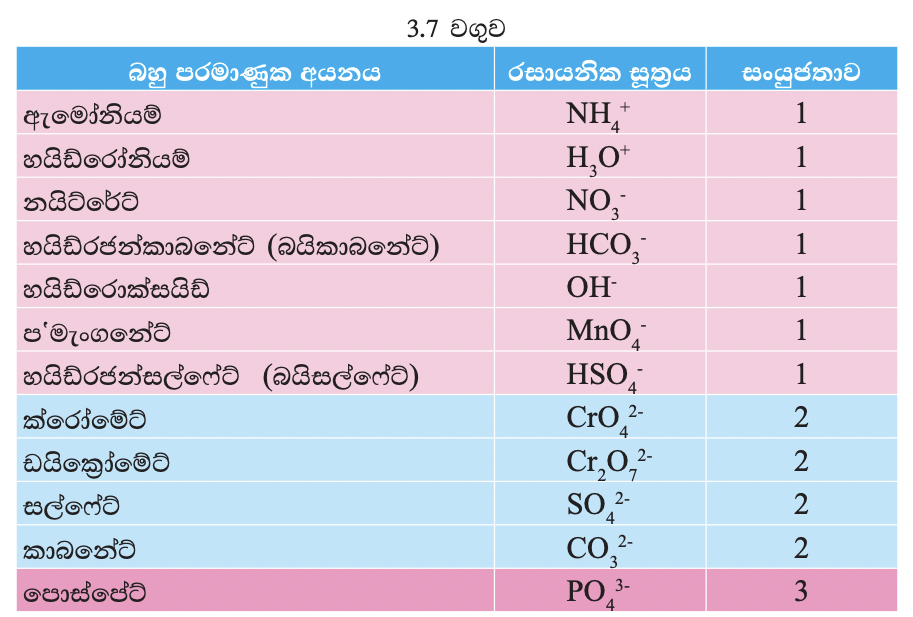
■ බහු පරමාණුක අයන (අයන ඛණ්ඩක)
බහු පරමාණුක අයනයක් යනු ආරෝපණයක් සහිත කිසියම් රටාවකට සැකසුණු මූලද්රව්ය පරමාණු එකතුව කි.


Responses